 pH
pH
E’ l a misura del grado di acidità di
una sostanza. La scala del pH va da 0 a 14.
Il pH = 7 corrisponde alla neutralità ( sostanza né acida
né alcalina).
Valori di pH bassi (p H < 7) indicano la presenza di acidi, valori
elevati (p H > 7) indicano la presenza di sostanze alcaline ( chiamate
anche basi).
Nell'analisi delle acque un valore di pH che si allontana molto da 7 è
quindi indice di un forte inquinamento dovuto a scarichi industriali di
acidi forti o di basi forti. Le piogge acide
hanno abbassato il pH di molti laghi e fiumi,
compromettendone la vita acquatica. Infatti a valori di pH acidi le sostanze
chimiche disciolte nell’acqua diventano molto più tossiche
della norma.
L’acqua del mare è poco sensibile alle piogge acide, in quanto
i sali in essa disciolti esercitano lo stesso effetto tampone del bicarbonato.
Normalmente il pH del mare è 8,1 in superficie e 7,1 in profondità.
La vita acquatica incontra seri problemi se i valori di pH sono inferiori
a 6,5 o superiori a 8,2.
Le acque da noi analizzate hanno un pH che va da 7,5 a 7,8 e che quindi non è molto lontano dal valore di neutralità. Questo grazie alla presenza di bicarbonati che “tamponano” il valore di pH, cioè proteggono l’acqua dall’effetto delle piogge acide.
 AZOTO
(N)
AZOTO
(N)
Come componente essenziale delle proteine, si trova in tutte le cellule, come azoto inorganico si trova in natura sotto forma di gas libero (che costituisce circa l’80% dell’aria), nei nitriti , nei nitrati, nell’ammoniaca, nei sali di ammonio.
NITRATI (NO3-)Sono presenti nei fertilizzanti e sono portati nelle acque dalla pioggia che dilava il terreno. Stimolano la crescita di plancton e piante acquatiche provocando l’ eutrofizzazione delle acque.L’inquinamento delle acque da nitrati è prodotto soprattutto dalle aziende agricole. Una limitata concentrazione di nitrati è sempre presente nelle acque, perché deriva dalla naturale decomposizione degli organismi acquatici. E’ accettabile una concentrazione di nitrati inferiore ai 10 mg/l.
NITRITI (NO2-) Anch’essi derivano dalla decomposizione di organismi viventi. Hanno vita breve perché sono subito convertiti in nitrati dai batteri. Sono molto tossici, producono una serie di gravi malattie nei pesci, reagiscono con l’emoglobina impedendo al sangue di trasportare ossigeno. La concentrazione di nitriti non deve superare 1 mg/l.
AZOTO AMMONIACALE: AMMONIACA (NH3)
e IONE AMMONIO (NH4+)
L’ammoniaca è un gas dall’odore pungente, incolore. In
natura si forma in seguito all’azione di batteri su sostanze contenenti
azoto, come le proteine e l’urea. E’ usata in molti prodotti
per la pulizia della casa e nei
fertilizzanti,in questi ultimi sotto forma di sali di ammonio. Questa
sostanza, oltre ad accelerare il processo di eutrofizzazione
delle acque è tossica per tutti i viventi. Se la sua concentrazione
supera i 0,06 mg/l, l’acqua è considerata inquinata. Le trote
non vivono ad una concentrazione di ammoniaca superiore ai 0,2 mg/l
 CLORO
CLORO
E’ un gas giallo verde dall’odore pungente che si scioglie facilmente in acqua. E’ un ottimo disinfettante per le acque potabili e per il trattamento delle acque di scarico. Viene usato come sbiancante nell’industria tessile e della carta. Va aggiunto all’acqua in piccola quantità ( sono sufficienti 0,5 mg/l per uccidere i batteri), perché in quantità più elevate può uccidere pesci ed organismi acquatici.
CLORUR0 DI SODIO (NaCl) E’ il normale sale da cucina. La sua concentrazione nelle acque superficiali è dovuta soprattutto agli scarichi urbani, in quanto il cloruro di sodio, presente in quasi tutti gli alimenti, viene eliminato senza essere trasformato dal processo digestivo. Se la concentrazione dei cloruri è elevata, si è in presenza anche di scarichi industriali.
La presenza di ossigeno in acqua è indispensabile per la respirazione degli organismi acquatici. In un fiume senza ossigeno non c’è vita. La quantità di ossigeno necessaria dipende dal numero e dal tipo di organismi, dalle loro condizioni, dalla temperatura dell’acqua, dalla presenza di inquinanti. I batteri bioriduttori utilizzano l'ossigeno disciolto nell'acqua per decomporre le sostanze organiche riversate nei fiumi dagli scarichi urbani o industriali. Parte dell'ossigeno è utilizzata per la trasformazione chimica di sostanze inquinanti.Con il fenomeno dell’eutrofizzazione la quantità di ossigeno disciolto diminuisce considerevolmente.
 ANIDRIDE
CARBONICA (CO2)
ANIDRIDE
CARBONICA (CO2)
E’ un gas inodore prodotto durante la respirazione di animali, piante e batteri. La reazione della respirazione, che serve per produrre l’energia necessaria per le funzioni vitali, è la seguente:
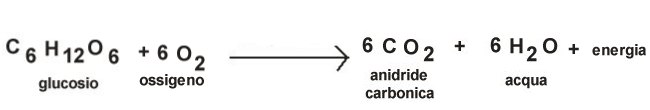
Le piante verdi, attraverso la fotosintesi clorofilliana,
svolgono il processo inverso utilizzando l’anidride carbonica per
produrre glucosio secondo la reazione:

La presenza di anidride carbonica è quindi
necessaria per la vita acquatica, ma un suo eccesso risulta nocivo per
i pesci e gli altri animali acquatici.
Il valore massimo accettabile di anidride carbonica dipende dalla quantità
di ossigeno disciolto e dalla temperatura dell’acqua. Quando il livello
di anidride carbonica è elevato e quello di ossigeno basso, specie
se ad un’elevata temperatura, i pesci hanno problemi a respirare.
Il valore ottimale di anidride carbonica è tra i 6 mg/l ed i 10
mg/l. Con valori superiori a 30 mg/l i pesci più sensibili muoiono.
 ALCALINITA’
ALCALINITA’
Misura la capacità di una soluzione di”tamponare”
il pH, cioè di non modificarlo in seguito all’aggiunta di
acidi o di basi. E’ positiva per i pesci e la vita acquatica perché
li difende dalle piogge acide.
Può essere data dalla presenza di CARBONATI
(CO32-), BICARBONATI
(HCO3-) ed IDROSSIDI
(OH-).
Sono alcaline, e quindi meno sensibili alle piogge acide, le acque che scorrono attraverso rocce calcaree, mentre quelle che scorrono attraverso rocce granitiche hanno una scarsa alcalinità.
L’alcalinità delle acque da noi analizzate è determinata esclusivamente alla presenza di bicarbonati.
 DUREZZA
DUREZZA
Registra la concentrazione di ioni (Ca2+) e (Mg2+) presenti in sali come i carbonati di calcio e i bicarbonati di calcio, il cosiddetto "calcare". Se l'acqua è "dura" contiene molto calcare, come l'acqua di rubinetto che con il tempo lascia macchie bianche sulle superfici che non vengono asciugate subito.
L’acqua dei nostri fiumi è risultata essere dura.
 SOLFITI (S032-)
SOLFITI (S032-)
Sono sostanze inquinanti contenenti zolfo. In genere
vengono aggiunti all’acqua negli impianti industriali per ridurre
la quantità di ossigeno disciolto e quindi proteggere le tubature
dalla corrosione. Sono difficilmente presenti nell’acqua in concentrazioni
apprezzabili in quanto si trasformano rapidamente in solfati.