SPETTROFOTOMETRIA UV-VISIBLE
Sommario
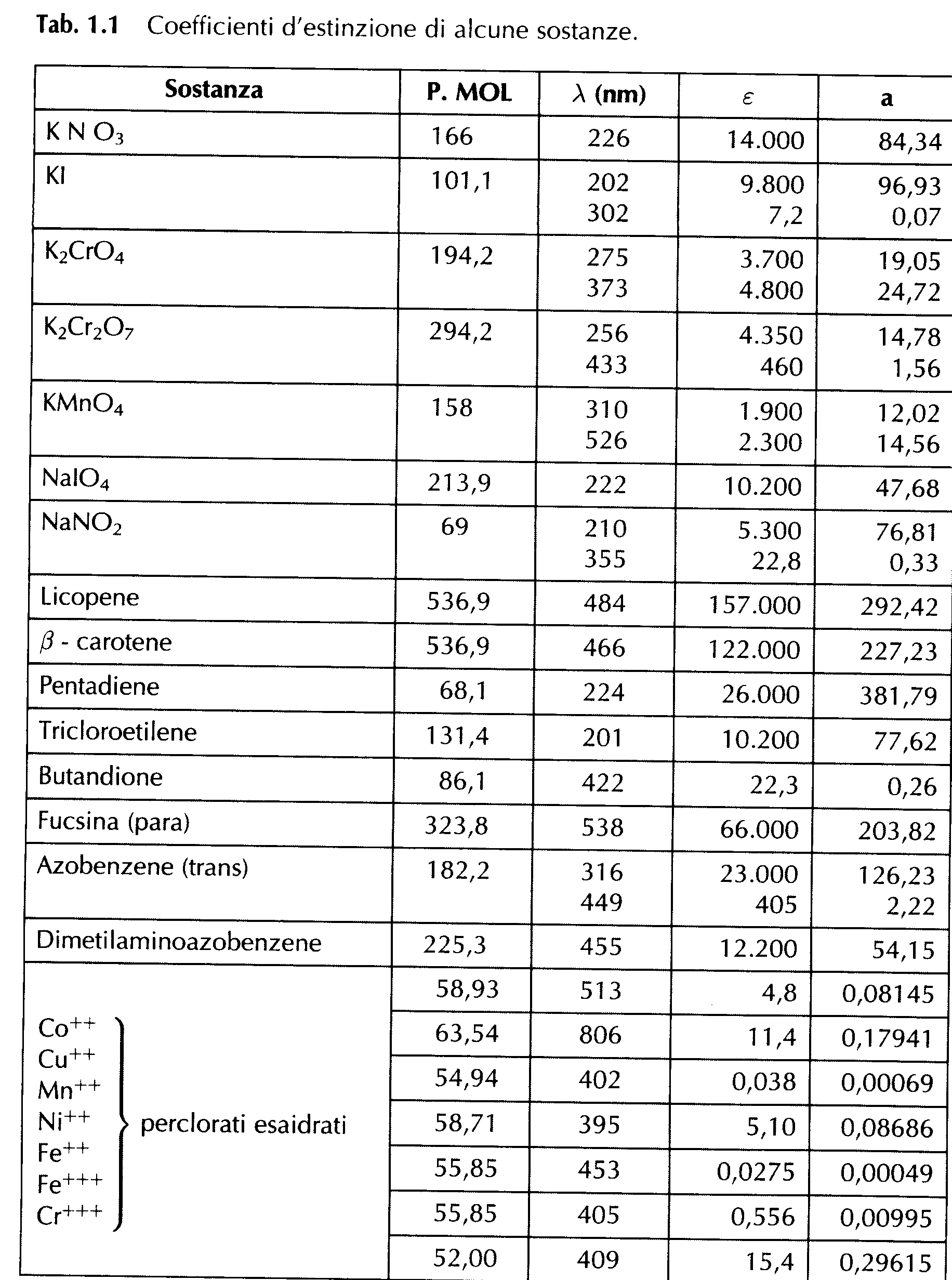
TEORIA DELL'UV-VISIBILE *
ASSORBIMENTO NELL'UV-VISIBILE *
ASSORBIMENTO DEI COMPOSTI ORGANICI *
ASSORBIMENTO DEI COMPOSTI DI COORDINAZIONE *
SCHEMA A BLOCCHI DI UNO SPETTROFOTOMETRO UV-VISIBILE *
GAMMA DELLE RADIAZIONI ELETTROMAGNETICHE *
SPECIFICHE TECNICHE DI UNO SPETTROFOTOMETRO UV-VIS *
IMPOSTAZIONI PER UNA SCANSIONE SPETTROFOTOMETRICA UV-VIS *
GRAFICO DELLA SCANSIONE DI UNA SOLUZIONE ACETONE/ACQUA *
PREPARAZIONI
DI SOLUZIONI STANDARD (STN) *
IMPOSTAZIONI PER UNA CURVA DI STANDARD SPETTROFOTOMETRICA UV-VIS *
CURVA DI TARATURA CON L'USO DI 4 STANDARD ACETONE/ACQUA *
La spettrofotometria molecolare Uv-Visibile si basa
sull'assorbimento selettivo, da parte
di molecole, delle radiazioni con λ=10÷780 nm.
·
UV
lontano 10
÷ 200 nm.
·
UV vicino
10 ÷ 380 nm.
·
Visibile
380 ÷ 780 nm.
Il Visibile comprende:
·
Viola
380 ÷ 450 nm.
·
Blu
450 ÷ 495 nm
·
Verde
495 ÷ 550 nm
·
Giallo-Verde
550 ÷ 570 nm
·
Giallo
570 ÷ 590 nm
·
Arancio
590 ÷ 620 nm
·
Rosso
620 ÷ 780 nm
·
(IR Vicino
780 ÷ 1900nm)
Per eccitare gli elettroni di valenza di una molecola
si ha bisogno di tanto più energia quanto più è grande la separazione tra i
livelli elettronici di partenza e di arrivo delle transizioni.

Le corrispondenti lunghezze d'onda sono:
·
·
·
La lunghezza d'onda necessaria alle diverse
transizioni è tanto maggiore quanto minore è il dislivello di energia.
(f -----> f).
ASSORBIMENTO DEI COMPOSTI ORGANICI
·
la transizione E (o etilenica) di sistemi л
isolati;
·
la transizione B (o benzenoide) di anelli benzenici;
·
la transizione K (o di coniugazione) di sistemi aromatici o coniugati;
·
Transizioni per trasferimento di carica. Sono dovuti a veri e propri spostamenti di elettroni
da una parte all'altra della molecola e di solito forniscono le bande più
intense dello spettro. I composti aromatici sostituiti presentano bande di
questo tipo che cadono nell'intervallo 220-370 nm.
ASSORBIMENTO DEI COMPOSTI DI COORDINAZIONE
Gli
spettri dei composti di coordinazione mostrano le bande di assorbimento dei
leganti insieme all'assorbimento caratteristico dei metalli di transizione (che
hanno orbitali d) o dei lantanidi (che hanno orbitali f)
e l'assorbimento per trasferimento di carica.
Transizioni per trasferimento di carica. Spesso i composti di coordinazione,ma anche gli ioni
di etalli di transizione (come MnO4-
o CrO42-) e i complessi molecolari (come fra I2 e il benzene) mostrano una colorazione molta
intensa. L'intenso assorbimento nel visibile da parte di queste specie è
associato a transizioni elettroniche che producono forti variazioni nel momento
di dipolo. In particolare, per ioni e composti di coordinazione si parla di trasferimento
di carica intramolecolare perché si
verifica un vero e proprio trasferimento di un elettrone dall'atomo centrale ai
leganti, e viceversa. Il caso più frequente consiste nel trasferimento di un
elettrone dal legante al metallo. In una transizione elettronica di questo tipo
si verifica una forte variazione del momento di dipolo.
I
fattori che facilitano il trasferimento di carica sono l'acidità (il potere
ossidante) dello ione centrale e la basicità (il potere riducente) del legante.
Esempio:
l'AgI è giallo mentre l'AgCl è
bianco, ciò si spiega perché lo ione I- è più basico (riducente)
dello ione Cl- e quindi tende a cedere un elettrone con più facilità,
il trasferimento elettronico da parte di I- richiede l'assorbimento di un fotone nella regione del blu, al limite
del visibile, e perciò AgI appare giallo.
Il
trasferimento di carica è il primo stadio verso l'ossidazione del legante e
quindi, la rottura del legame con il metallo, è indice in molti casi, di scarsa
stabilità della molecola (o dello ione). Il colore giallo dello ione CrO42- deriva dal trasferimento di un elettrone di non
legame dall'ossigeno ad un orbitale del cromo.
Lo
ione MnO4-, che è un ossidante più energico di CrO42- appare
di colore violetto, perché il trasferimento elettronico è relativamente più
facile (e avviene a lunghezze d'onda maggiori).
Per
i complessi molecolari si parla di trasferimento di carica intermolecolare. Nel caso di I2 in benzene si pensa che l'intensa colorazione marrone scuro sia dovuta
al trasferimento di un elettrone л del benzene in un orbitale molecolare vuoto di I2. in tetracloruro di carbonio o in un solvente
idroalcolico, I2 dà invece una
colorazione viola perché non si formano complessi di questo tipo.
LEGGE DELL'ASSORBIMENTO
in via di allestimento............................
SPETTROFOTOMETRO UV-VIS (caratteristiche di uno strumento)
Specifiche
tecniche
Banco
ottico:
Doppio raggio virtuale, ottica
ricoperta in quarzo, reticolo
Interferometrico Master, Monocromatore con 1200 linee
Campo
spettrale:
190 ¸ 1100
nm
Banda
Passante:
2 nm
Luce
Diffusa:
< 0.05% @ 220 nm & 340 nm
Accuratezza
Abs @ 1A: ± 0.005A
Ripetibilità
Abs @ 1A:
± 0.002 nm
Accuratezza
l:
1 nm
Ripetibilità
l:
± 0.2 nm
Stabilità:
< 0.001 A/hr
Rumore:
< 0.0001 A
Video:
Grafico LCD risoluzione VGA
Cambiacelle:
Automatico a 7 posizioni
Interfaccia
per computer: RS232
Sorgente:
Deuterio e Tungsteno auto allineati con cambio
automatico programmabile
Interfaccia
Stampante:
Cectronics Parallela
Dimensioni:
455
x 395 x 215
Alimentazione:
da 90 a 264 V
IMPOSTAZIONI PER UNA SCANSIONE SPETTROFOTOMETRICA UV-VIS
07/02/01 1 0.178A
10:00
190.0 nm
*
SCANSIONE *
|
TIPO
SCAN. |
:
INTELLISCAN - STANDARD |
|
ID |
:
nome analisi |
|
MODO |
:
ABS - %T - I - 1D
- 2D
- 3D -
4D |
|
INIZIO |
:
190.0 nm |
|
FINE |
:
1100.0 nm |
|
B.
PASSANTE |
: 2.0 nm |
|
VELOCITA' |
: ESAMINA |
|
INTERV.
PUNTI |
: 2.0 nm |
|
TAB.
PICCHI |
:
PICCHI & VALLI |
|
GRAF
MAX |
:
2.000 |
|
GRAF
MIN |
:
0.000 |
|
CAMBIO
LAMP |
: (315-320-325-330-335-340)nm D2-W |
|
OPERATORE: |
: nome |
|
PROG.
CUVETTE: |
: AUTO |
|
|
STAMPA METODO |
SALVA METODO |
GUARDA GRAFICO |
GUARDA RISULTAT. |
GRAFICO DELLA SCANSIONE
DI UNA SOLUZIONE ACE

01.12.01
1
0.178A
10:00
550.0 nm
* QUANT *
|
ID |
:
nome analisi |
|
LUNG.
D'ONDA |
:
550 nm (scelta del max
assorbimento) |
|
B.
PASSANTE |
: 2.0
nm |
|
INTEGRAZIONE |
: 1
s (max 9999 s) |
|
No.
STANDARD |
:
4 (max 6) |
|
RIPETIZIONE |
:
1 - 2 - 3 |
|
UNITA' |
:
concentrazione |
|
TIPO
CURVA |
:
LINEARE (quadratica) (per
lo 0) |
|
CAMBIO
LAMP |
:
(315-320-325-330-335-340)nm D2-W |
|
OPERATORE |
:
nome |
|
PROG.
CUVETTE |
:
AUTO |
|
STANDARDS |
STAMPA METODO |
SALVA METODO |
GUARDA RISULTATI |
GUARDA CALIBRAZ. |
* PROG.
CUVETTE *
|
POSIZ.
CUVETTA |
:
1 (max 2) |
|
MODO |
:
AUTO (manuale, leggi e avanza, off) |
|
RIF. MODO |
:
ON (OFF) |
|
ULTIMA
CUVETTA |
:
1 ¸
7 |
|
CICLI
CUVETTE |
:
1 ¸
300 |
|
VELOCITA' |
:
ALTA - MEDIA - MASSIMA |
|
STD |
CONC |
ASSORBANZA |
||
|
|
mg/l, ppm... |
RIP. 1 |
RIP. 2 |
RIP. 3 |
|
1 |
2.000 |
-.--- |
-.--- |
-.--- |
|
2 |
5.000 |
-.--- |
-.--- |
-.--- |
|
3 |
8.000 |
-.--- |
-.--- |
-.--- |
|
4 |
10.000 |
-.--- |
-.--- |
-.--- |
PREPARAZIONE
DI SOLUZIONI STANDARD (STN)
4.
Per la prima diluizione si decide di usare un matraccio tarato da 1000 ml
e , quindi di preparare 1 litro di standard contente 10 mg/l di campione. Si
prelevano 10 ml di sol. madre e si portano a volume con acqua distillata.
3.
Per la seconda diluizione si decide di usare un matraccio da 100 ml
contenente 8 mg/l di campione. Si prelevano 80 ml di sol. Í
e si portano a volume con acqua distillata.
2.
Per la terza diluizione si decide di usare un matraccio da 100 ml
contenente 5 mg/l di campione. Si prelevano 50 ml di sol. Í
e si portano a volume con acqua distillata.
1.
Per la quarta diluizione si decide di usare un matraccio da 100 ml
contenente 2 mg/l di campione.Si prelevano 20 ml di sol. Í
e si portano a volume con acqua distillata.
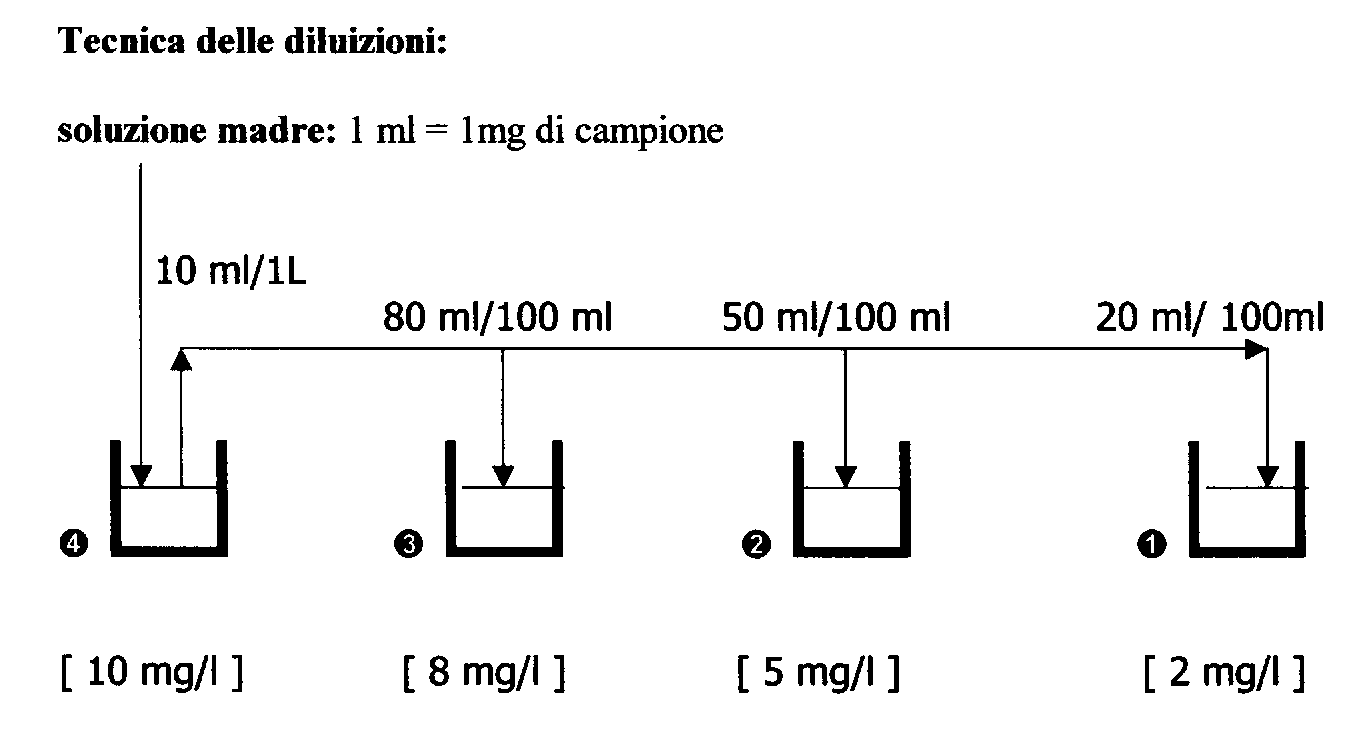
CURVA DI TARATURA CON L'USO DI 4 STANDARD ACETONE/ACQUA:
200 - 400 - 600 - 1000 ppm