|
Comitato Cittadino per la Tutela della Salute e dell'Ambiente |
|
Casaluce(Ce) |
|
Inquinamento
|
L’inquinamento atmosferico è un complesso di effetti nocivi che si ripercuotono sulla biosfera e quindi sull'uomo, dipendenti dall'azione di fattori di alterazione (inquinanti) degli equilibri esistenti, liberati per lo più come sottoprodotti dell'attività umana nell'aria.
L’inquinamento atmosferico può essere definito come la presenza in atmosfera di sostanze che nella naturale composizione dell’aria non sono presenti o sono presenti ad un livello di concentrazione inferiore, e che producono un effetto misurabile sull’uomo, sugli animali, sulla vegetazione o i materiali.

Le sostanze inquinanti liberate nella biosfera sono per lo più prodotte dall'attività umana nel suo vario svolgersi.
Responsabili principali dell'inquinamento atmosferico sono i veicoli con motore a scoppio, le industrie, le centrali termoelettriche, i combustibili per il riscaldamento domestico, la combustione dei rifiuti specie se realizzata senza di adatti impianti di abbattimento delle polveri e di depurazione dei fumi.

Vengono definiti inquinanti primari gli inquinanti direttamente emessi dalle sorgenti.
I principali inquinanti primari sono quelli emessi dai processi di combustione di qualunque natura, ovvero gli idrocarburi incombusti, il monossido di carbonio, gli ossidi di azoto (principalmente sotto forma di monossido) ed il materiale particellare. Nel caso in cui i combustibili contengano zolfo, si ha inoltre anche emissione di anidride solforosa.
A seguito dell’emissione in atmosfera, gli inquinanti primari sono soggetti a processi di diffusione, trasporto e deposizione, nonché a processi di trasformazione chimico-fisica che possono portare alla formazione di nuove specie inquinanti, che spesso risultano più tossici e di più vasto raggio d'azione degli inquinanti originari.
La dispersione degli inquinanti in atmosfera, determinata dai fenomeni di diffusione turbolenta e di trasporto delle masse d’aria, come pure la loro rimozione, determinata dai processi di deposizione, sono strettamente dipendenti dal comportamento dinamico dei bassi strati dell’atmosfera. Ne consegue che per lo studio del comportamento degli inquinanti primari è necessario sia conoscere il profilo qualitativo, quantitativo e temporale delle emissioni, sia avere informazioni sui processi meteorologici che regolano il comportamento dinamico della bassa troposfera (classi di stabilità, direzione ed intensità del vento).

Vengono definiti inquinanti secondari quelle specie inquinanti che si formano a seguito di trasformazioni chimico-fisiche degli inquinanti primari, ovvero delle specie chimiche direttamente emesse in atmosfera dalle sorgenti.
Fra i processi di formazione di inquinanti secondari, particolare importanza è assunta dalla serie di reazioni che avvengono fra gli ossidi di azoto e gli idrocarburi in presenza di luce solare. Questa catena di reazioni porta all’ossidazione del monossido di azoto (NO) a biossido di azoto (NO2), alla produzione di ozono (O3) ed all’ossidazione degli idrocarburi, con formazione di perossiacetilnitrato (PAN), formaldeide, acido nitrico, nitrati e nitroderivati in fase particellare, e centinaia di altre specie chimiche minori. L’insieme dei prodotti di queste reazioni viene definito come smog fotochimico, che rappresenta una delle forme di inquinamento più dannose per l’ecosistema. L’uso del termine smog è dovuto alla forte riduzione della visibilità che si determina nel corso degli episodi di inquinamento fotochimico, dovuta alla formazione di un grande numero di particelle di notevoli dimensioni.

Per l’innesco di un processo di smog fotochimico è necessaria la presenza di luce solare, ossidi di azoto e composti organici volatili; inoltre, il processo è favorito dalla temperatura atmosferica elevata. Poichè gli ossidi di azoto ed i composti organici volatili sono fra i componenti principali delle emissioni nelle aree urbane, le città poste nelle aree geografiche caratterizzate da radiazione solare intensa e temperatura elevata (es. aree mediterranee) costituiscono dei candidati ideali allo sviluppo di episodi di inquinamento fotochimico intenso. Le conoscenze che è necessario acquisire per poter comprendere gli eventi di inquinamento secondario riguardano quindi i processi di trasformazione chimica e chimico-fisica degli inquinanti, i processi dinamici della bassa atmosfera (classi di stabilità, direzione ed intensità del vento) e l’intensità della radiazione solare.
Nella bassa atmosfera, l’ozono si forma dalla reazione dell’ossigeno atmosferico con l’ossigeno atomico prodotto dalla fotolisi del biossido di azoto, e l’ozono formato viene a sua volta rimosso dal monossido di azoto, con nuova formazione di NO2:
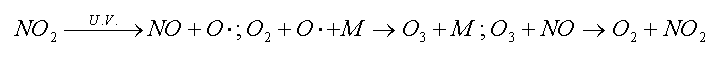
Nelle atmosfere non inquinate, ove non sono presenti altre specie chimiche in concentrazione apprezzabile, questa serie di reazioni costituisce un ciclo (ciclo fotostazionario dell’ozono) e non vi è alcuna possibilità di inquinamento fotochimico. Il passaggio fondamentale affinché l’atmosfera si possa arricchire di ozono e di altre specie fotossidanti (ovvero di specie chimiche ossidanti formate mediante reazioni chimiche che avvengono solo in presenza di luce) è costituito dalla formazione di NO2 attraverso vie alternative, che non implicano la rimozione di ozono. L’identificazione delle di vie di formazione di NO2 costituisce quindi la chiave di volta per la comprensione dei processi fotochimici ossidativi.
La principale via alternativa per la formazione di NO2 è costituita dall’ossidazione di NO ad opera dei radicali perossido (RO2). Questi radicali liberi si formano dalla degradazione di molecole di idrocarburi volatili (RH) e dalla loro successiva reazione con l’ossigeno atmosferico. L’attacco agli idrocarburi volatili è dovuto alla presenza in atmosfera di altri radicali liberi, i radicali ossidrile (OH):
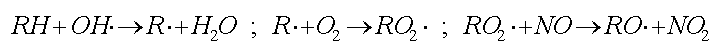
I processi che generano i radicali ossidrile costituiscono quindi i processi fondamentali per l’avvio dei processi di inquinamento fotochimico.
La produzione di radicali OH è anche essa fondamentalmente di tipo fotochimico, ed i principali precursori sono l’acido nitroso, la formaldeide e lo stesso ozono. L’ozono, dunque, non è solo il prodotto quantitativamente più importante dei processi di inquinamento fotochimico, ma è anche parte del "combustibile" che attiva il processo. Lo stesso vale, in misura diversa, per l’acido nitroso e la formaldeide, che sono precursori di radicali OH ma che hanno a loro volta una via di formazione essenzialmente secondaria a partire da specie coinvolte nei processi fotochimici (biossido di azoto per l’acido nitroso e idrocarburi e radicali oppure ozono per la formaldeide). Queste osservazioni permettono di comprendere per quale motivo gli episodi acuti di smog fotochimico spesso persistano, con intensità crescente, per più giorni consecutivi.
La genesi di un evento di smog fotochimico consta quindi di diverse fasi, che possono essere così schematizzate:
|
un’atmosfera ricca di inquinanti primari, quali ossidi di azoto e idrocarburi volatili, nonché di precursori di radicali OH, come acido nitroso, formaldeide e ozono, viene investita dalla radiazione solare UV |
|
|
la radiazione UV provoca la fotolisi di acido nitroso, formaldeide ed ozono (in ordine crescente di livello di energia ultravioletta necessaria per la fotolisi), con produzione di radicali OH. |
|
|
i radicali OH attaccano varie specie di idrocarburi volatili reattivi, innescando una serie di reazioni a catena che portano alla degradazione delle molecole di idrocarburi e alla formazione di radicali perossido. |
|
|
i radicali RO2 ossidano il monossido di azoto, producendo NO2; ogni radicale partecipa a parecchi cicli di conversione di NO ad NO2 prima di estinguersi. |
|
|
il biossido di azoto, per fotolisi, produce ozono, rigenerando una molecola di NO che torna ad essere disponibile per una nuova ossidazione; |
|
|
in alternativa, il biossido di azoto reagisce con radicali OH, formando acido nitrico, o con radicali perossiacetile formando perossiacetilnitrato (prodotti terminali che esauriscono la catena di reazioni) e viene in tal caso rimosso dal ciclo fotochimico. |

La concentrazione degli inquinanti nell’atmosfera è determinata non solo dal numero e dall'intensità delle sorgenti di inquinamento, dalla distanza da tali sorgenti e dalle trasformazioni chimico-fisiche cui vengono sottoposti, ma soprattutto dalle condizioni meteorologiche locali (per i fenomeni di inquinamento a scala locale) e dalle condizioni meteorologiche locali e a grande scala (per i fenomeni di inquinamento a grande distanza dalle sorgenti), che spesso costituiscono il parametro chiave per la comprensione della genesi, dell’entità e dello sviluppo nel tempo di un evento di inquinamento atmosferico.
Per i fenomeni di inquinamento a scala locale l'influenza maggiore sul trasporto e la diffusione atmosferica degli inquinanti è dovuta all'intensità del vento, alle condizioni di turbolenza (meccanica e termodinamica) dei bassi strati atmosferici ed ad effetti meteorologici particolari quali le brezze (di mare o di monte), all'incanalamento del vento in valli strette, o nelle strade delle zone urbane, ecc. Per i fenomeni di inquinamento a grande scala, l'influenza maggiore sul trasporto e sulla diffusione degli inquinanti è dovuta alle variazioni del vento con la quota (shear del vento) e alla turbolenza determinata dalle aree cicloniche e anticicloniche.
In genere, a parità di emissione di inquinanti dalle sorgenti, le concentrazioni in aria a piccola scala (zone urbane, zone industriali, ecc.) sono minori quando il vento è moderato o forte e l'atmosfera è instabile nei bassi strati, oppure quando il vento è debole o assente ma vi è forte insolazione con cielo sereno e sole alto sull'orizzonte. Viceversa, le concentrazioni diventano elevate quando vi è inversione del gradiente termico verticale o in condizioni di alta pressione di notte e con vento debole, oppure in condizioni di nebbia persistente che provoca processi di accumulo.
Le inversioni termiche
Nei 10 km inferiori dell’atmosfera (troposfera) la temperatura dell’aria generalmente decresce con l’altezza di circa 7 °C per Km; le masse d’aria più calde, vicine alla superficie terrestre, a causa della loro minore densità tendono a salire verso l’alto e vengono sostituite da masse d’aria più fredde provenienti dall’alto. La conseguenza di questo processo è il rimescolamento degli strati inferiori della troposfera.
In alcuni casi, tuttavia, la temperatura dell’aria ad una certa altezza e per alcune decine o centinaia di metri, può avere un andamento crescente con l’altitudine, per poi cominciare a decrescere di nuovo. Questa zona, nota come strato di inversione, agisce come un ostacolo sugli strati inferiori di aria più freddi che, a causa della loro maggiore densità, non possono attraversarla. In queste condizioni, gli inquinanti prodotti al suolo non vengono rapidamente miscelati con l’intera troposfera, ma restano confinati nel volume di aria al di sotto dello strato di inversione, con conseguente aumento della loro concentrazione.
Un primo tipo di inversione termica che è spesso causa di eventi di inquinamento nei siti urbani è l’inversione di tipo radiativo. L’inversione radiativa è generata dal rapido raffreddamento sia della superficie terrestre che dello strato di aria immediatamente al di sopra di questa, dovuto all’emissione di radiazione infrarossa subito dopo il tramonto. Durante le notti limpide, in condizione di alta pressione, questo raffreddamento può essere così rapido che lo strato d’aria adiacente alla superficie terrestre diviene più freddo dello strato immediatamente superiore, con formazione di uno strato di inversione in genere a quote piuttosto basse (50 metri). Questa condizione persiste fino a che il riscaldamento mattutino della superficie e dell’aria al di sopra di essa risulta sufficiente a "rompere" lo strato di inversione.
Un altro tipo di inversione termica che si verifica frequentemente nell’area di Roma è quella generata dalla brezza di mare, ovvero dallo spostamento orizzontale delle masse d’aria che si trovano al di sopra di una superficie più calda, quale il mare nelle ore notturne, verso una massa d’aria o una superficie più fredda, quale la terra. Questo tipo di inversione ha in genere un’altezza maggiore di quella di tipo radiativo (poche centinaia di metri) e la sua intensità e persistenza è spesso la causa dell’insorgere nell’area romana di fenomeni di inquinamento fotochimico di notevole intensità. L’inversione ha termine quando il riscaldamento mattutino della superficie terrestre è sufficientemente intenso per generare una efficace spinta verso l’alto delle masse d’aria sovrastanti; in caso contrario, l’inversione può persistere in quota anche per diversi giorni, innescando un fenomeno di smog fotochimico, che si prolunga, con intensità crescente, per più giorni consecutivi (multi-day smog episode).
Altri parametri meteorologici che rivestono un’importanza notevole per i fenomeni di inquinamento urbano sono i campi di vento, che favoriscono il trasporto orizzontale degli inquinanti, e la temperatura ed intensità della radiazione solare, che hanno una importanza fondamentale nella genesi degli episodi di inquinamento fotochimico.
Effetti sul clima
L'aumento del tenore di anidride carbonica, CO2, nella troposfera, in conseguenza dell'incremento del consumo di combustibili e del diboscamento attuato per far posto a nuovi spazi agricoli, non è insignificante, essendo passato, nell'arco di un secolo, da 290 a 320 ppm (parti per milione) e prevedendosi per il 2000 valori tra 375 e 400 ppm.
Dato che è soprattutto la presenza, seppur nel complesso modesta, di anidride carbonica e di vapore acqueo nella troposfera che, trattenendo la maggior parte del flusso di energia termica irradiata dal suolo in conseguenza del fenomeno noto come effetto serra, regola la temperatura del globo, una variazione sensibile della percentuale di anidride carbonica non può non avere ripercussioni climatiche: infatti, da più parti si è messo in relazione l'aumento dell'anidride carbonica nell'atmosfera con l'aumento della temperatura media mondiale accertato durante i cento anni precedenti il 1940. Da allora però, nonostante l'anidride carbonica continui a essere immessa nell'atmosfera in quantità sempre maggiori, la temperatura media mondiale ha mostrato una leggera diminuzione che è interpretata come conseguenza dell'aumentato potere riflettente, o albedo, della Terra, dovuto all'intensificarsi dell’intorbidamento atmosferico da parte dei fumi e delle polveri prodotti da attività industriali e agricole e da eruzioni vulcaniche particolarmente ricche di polveri (p. es. quella del Pinatubo, nelle Filippine, del 1991). Va ricordato che le particelle di fumi e polveri, agendo da nuclei di condensazione per il vapore acqueo, favoriscono la formazione di nubi che aumentano ulteriormente l'albedo.
Gli effetti della torbidità atmosferica si manifestano soprattutto negli strati più bassi e in specie nelle aree altamente industrializzate con notevole riduzione della visibilità e aumento di foschie, nebbie, nuvolosità e precipitazioni, al punto che le città industriali hanno un numero di giornate nuvolose e piovose superiore a quello delle campagne circostanti.
A causa dei contrastanti effetti dovuti all'aumento del tenore di anidride carbonica da una parte e alla nuvolosità e torbidità atmosferica dall'altra e inoltre delle attuali incomplete conoscenze del ruolo dei numerosi fenomeni geofisici che intervengono nel bilancio di radiazione della Terra, è impossibile stabilire con sicurezza quali siano le conseguenze a lunga scadenza di questi mutamenti indotti dall'uomo sull'atmosfera. Un'altra conseguenza dell'inquinamento, con riflessi sul clima valutati dagli scienziati in modo controverso, è l'accumulo di calore di scarto liberato nell'atmosfera dalle varie attività produttrici di calore: per alcuni la quantità di calore somministrata all'ambiente è già superiore a quella smaltibile per irradiazione nello spazio e quindi la temperatura è destinata a salire con profonda alterazione del clima nell'arco di qualche decennio, per altri l'aumento di calore può essere compensato da attività che elevino l'albedo come l'espandersi delle superfici di cemento e di asfalto delle aree urbane o l'estendersi dei deserti. In definitiva non si sa molto né sul complesso meccanismo di interazioni che regola l'ambiente fisico, né sulla portata delle interferenze climatiche prodotte dagli inquinamenti atmosferici. Solo il controllo sistematico della dispersione e delle modalità di trasporto degli inquinanti, delle variazioni dei valori di torbidità atmosferica, anidride carbonica e vapore acqueo, e in definitiva di tutto ciò che ha effetti sull'albedo, condotto su scala mondiale con l'aiuto di adatti satelliti meteorologici, potranno fornire più precise indicazioni sull'effettiva portata dell'alterazione dell'ambiente fisico.

| CO (Monossido di carbonio) |
| Sorgenti |
Il monossido di carbonio, CO, si forma durante la combustione delle sostanze organiche, quando questa è incompleta per difetto di ossigeno. La quantità maggiore di questa specie è prodotta dagli autoveicoli e dall'industria (impianti siderurgici e raffinerie di petrolio). Nettamente minore è l'emissione di CO dalle centrali termoelettriche e degli impianti di riscaldamento, perché la combustione è meglio controllata. Tra i motori degli autoveicoli, quelli a ciclo Diesel ne emettono in minima quantità, perché la combustione del gasolio avviene in eccesso di aria. Le emissioni naturali del monossido di carbonio comprendono l’ossidazione del metano e degli altri idrocarburi naturalmente emessi nell’atmosfera, l’emissione diretta dalle piante e l’attività microbica negli oceani. Le emissioni naturali ed antropogeniche di questa specie sono globalmente dello stesso ordine di grandezza. |
| Effetti sulla salute |
Il monossido di carbonio è un gas incolore, inodoro e fortemente tossico: esplica la sua azione sull’uomo formando con l'emoglobina un complesso irreversibile che inibisce il trasporto di ossigeno nel sangue, causando problemi al sistema respiratorio e, ad elevate concentrazioni, la morte per asfissia. L'affinità del CO per l'emoglobina è di oltre 200 volte superiore a quella dell'ossigeno: la carbossiemoglobina che si forma impedisce l'ossigenazione dei tessuti: i primi sintomi dell'avvelenamento sono cefalea e vertigine. Forti concentrazioni di CO in ambienti chiusi, provocate dal cattivo funzionamento di stufe e scaldabagni (generalmente per cattiva installazione o per otturazione dei camini) o dal funzionamento di motori, provocano la morte in breve tempo: 90 minuti in presenza di 1000 ppm di CO. Concentrazioni inferiori danno esito letale dopo alcune ore: ma il fatto che il monossido di carbonio sia inodoro impedisce alle vittime, colpite inoltre da sonnolenza, di avvertire il pericolo e di aerare il locale. L'esposizione prolungata a concentrazioni di 50 ppm (valore che viene spesso superato nelle vie a forte traffico) è notevolmente dannosa. La quantità di CO emessa dagli scarichi degli autoveicoli è negli ultimi anni diminuita a causa della migliorata efficienza dei motori, del controllo delle emissioni autoveicolari e dell’utilizzo di marmitte catalitiche. Attualmente, la concentrazione atmosferica localizzata di questo inquinante risulta in genere in diminuzione. |
| Ruolo in Atmosfera |
La concentrazione atmosferica di CO è di circa 120 ppb nella troposfera non inquinata e di 1-10 ppm nell’aria inquinata di aree intensamente urbanizzate. Il ruolo del monossido di carbonio nella chimica troposferica delle aree industrializzate è di trascurabile importanza, data la scarsa reattività di questa molecola. Il tempo medio di residenza del CO in atmosfera è di circa quattro mesi, e quindi il monossido di carbonio può essere utilizzato come tracciante dell'andamento temporale degli inquinanti primari al livello del suolo. |
| SO2 (Anidride solforosa) |
| Sorgenti |
L’emissione di anidride solforosa deriva dal riscaldamento domestico dai motori alimentali a gasolio, dagli impianti per la produzione di energia, ed in generale dalla combustione di carbone, gasolio ed oli combustibili contenenti piccole percentuali di zolfo, dalla produzione dell'acido solforico, dalla lavorazione di molte materie plastiche, dall'arrostimento delle piriti, dalla desolforazione dei gas naturali. L’emissione naturale di anidride solforosa proviene principalmente dai vulcani. Le emissioni naturali ed antropogeniche di questa specie sono all’incirca dello stesso ordine di grandezza. |
| Effetti sulla salute |
L’anidride solforosa è un gas fortemente irritante e già a 3 ppm se ne apprezza l’odore pungente. Gli effetti nocivi conseguenti alla sua inalazione interessano le mucose delle prime vie respiratorie e può causare costrizione dei bronchi in soggetti predisposti, anche a concentrazioni dell’ordine delle centinaia di ppb. |
| Ruolo in Atmosfera |
Per ossidazione radicalica, il biossido di zolfo forma acido solforico, ed è quindi coinvolto nei processi di acidificazione dell’atmosfera, che hanno effetti negativi sia sull’ecosistema che sui monumenti e manufatti umani. Negli ultimi anni, in seguito agli interventi operati sulla qualità dei combustibili, l’emissione di biossido di zolfo nelle aree urbane è stata drasticamente ridotta, e quindi la sua importanza come inquinante è notevolmente diminuita. I livelli tipici di concentrazione attualmente non superano le poche decine di ppb. |
| NO (Monossido di azoto) |
| Sorgenti |
Gli ossidi di azoto, monossido (NO) e biossido (NO2), che, essendo presenti contemporaneamente nell'aria, sono comunemente indicati come NOx e si formano da tutti i processi di combustione che avvengono ad alta temperatura. Il monossido di azoto si forma per reazione dell’ossigeno con l’azoto, nel corso di qualsiasi processo di combustione che avvenga in aria e ad elevata temperatura (T>2000°C); l’ulteriore ossidazione del monossido di azoto produce anche tracce di biossido di azoto, che in genere non supera il 5% degli NOx totali emessi. Le emissioni naturali di NO comprendono i fulmini, gli incendi e le emissioni vulcaniche e dal suolo. Le emissioni antropogeniche sono principalmente dovute ai trasporti, all’uso di combustibili per la produzione di elettricità e di calore ed, in misura minore, alle attività industriali. Forti quantità sono prodotte dai motori delle automobili, dagli impianti termici e dalle industrie che producono composti azotati. Si calcola che in Italia siano immessi nell'aria, a opera dell'uomo, 1,9 milioni di tonnellate l'anno di ossidi di azoto, metà dei quali prodotti dagli autoveicoli. Negli ultimi anni le emissioni antropogeniche di ossidi di azoto sono aumentate notevolmente e questa è la causa principale dell’incremento della concentrazione atmosferica delle specie ossidanti. Su scala globale, le emissioni naturali ed antropogeniche di NOx sono dello stesso ordine di grandezza. |
| Effetti sulla salute |
Il monossido di azoto non è causa di danni diretti all'uomo e all'ambiente in generale. |
| Ruolo in Atmosfera |
La concentrazione atmosferica del monossido di azoto è di 10-50 ppt nella troposfera non inquinata e di 50-750 ppb nell’aria inquinata. L’importanza del ruolo del monossido d’azoto in atmosfera è legata alla reazione di ossidazione che produce biossido d'azoto (NO2), intermedio fondamentale nei processi di inquinamento secondario ed in particolare di smog fotochimico. |
| COV - C6H6 (Benzene) |  |
| Sorgenti |
Per composti organici volatili (COV) si intende un insieme di classi di specie di natura organica caratterizzate da basse pressioni di vapore a temperatura ambiente che si trovano quindi in atmosfera principalmente in fase gassosa. Il numero dei composti organici volatili osservati in atmosfera, sia in aree urbane sia remote, è estremamente alto e comprende oltre agli idrocarburi (composti contenenti soltanto carbonio e ossigeno) anche specie ossigenate quali chetoni, aldeidi, alcoli, acidi ed esteri. Le emissioni naturali dei COV comprendono l'emissione diretta dalla vegetazione e la degradazione del materiale organico; le emissioni antropogeniche sono principalmente dovute alla combustione incompleta degli idrocarburi, all’evaporazione di solventi e carburanti, e alle industrie di trasformazione. Su scala globale, le emissioni naturali ed antropogeniche dei COV sono dello stesso ordine di grandezza. L’emissione di benzene nell'atmosfera è principalmente dovuta ai processi combustivi per la produzione di energia (inclusi i veicoli a motore) e per il riscaldamento domestico. Il benzene, prodotto commercialmente da petrolio, gas naturale e carbone, viene utilizzato come solvente e come intermedio nella produzione di composti chimici; tuttavia, da quando è stata riconosciuta la sua potenziale cancerogenicità, l’utilizzo di questa specie è stato notevolmente ridotto. |
| Effetti sulla salute |
Per gli effetti diretti sulla salute umana, particolare attenzione viene rivolta ai composti organici aromatici, che rientrano nella classe dei COV; tra gli aromatici volatili, la specie di maggiore interesse per l’inquinamento urbano è il benzene, relativamente stabile (tempo di vita medio di circa quattro giorni) e dotato di accertate proprietà cancerogene. |
| Ruolo in Atmosfera |
Il principale ruolo atmosferico dei composti organici volatili è connesso alla formazione di inquinanti secondari. In particolare, di maggiore interesse in campo atmosferico, a causa del loro importante ruolo nella formazione di specie ossidanti, è la classe degli alcheni, fra cui l’isoprene e i monoterpeni, composti particolarmente reattivi emessi naturalmente dalle piante. Il benzene è invece una molecola stabile e relativamente inerte e non ha un ruolo significativo nei processi di inquinamento secondario. Proprio per la sua stabilità e per la prevalente antropicità delle sue sorgenti questa specie può essere utilizzata come tracciante dell'andamento temporale degli inquinanti primari al livello del suolo. La concentrazione di benzene nelle aree urbane varia fra le poche unità e le poche decine di ppb. |
| IPA: C20H12 (Benzo(a)pirene) |  |
| Sorgenti |
Gli idrocarburi policiclici aromatici (IPA) sono composti organici la cui struttura è caratterizzata dalla fusione di due o più anelli aromatici. Gli idrocarburi policiclici aromatici possono derivare da sorgenti naturali (alghe, microrganismi, piante, incendi) ma la principale sorgente atmosferica è di origine antropica ed è la combustione incompleta degli idrocarburi. Nelle aree urbane la fonte principale di idrocarburi policiclici aromatici è rappresentata dagli scarichi autoveicolari. |
| Effetti sulla salute |
Gli idrocarburi policiclici aromatici si sono rivelati potenti cancerogeni, favorendo tra l'altro l'insorgere di tumori polmonari. Inoltre, assieme all'ossido di carbonio e al piombo tetraetile, gli idrocarburi, concorrono, a livello cellulare, al blocco enzimatico della catena respiratoria. In particolare il benzopirene, è dotato di forte azione cancerogena, soprattutto sulla cute e sulle strutture dell'apparato respiratorio. Gli IPA sono stati i primi inquinanti atmosferici classificati come cancerogeni e tra questi, quelli costituiti da quattro o più anelli aromatici sono ritenuti i più pericolosi. La legislazione italiana prescrive che nelle principali aree urbane siano determinate la concentrazione delle "polveri respirabili" (particelle con diametro aerodinamico inferiore a 10 µm) e la concentrazione in aria del solo Benz(a)Pirene (BaPy), che è il più potente cancerogeno tra gli idrocarburi policiclici aromatici non sostituiti, quantunque le specie appartenenti alla classe degli IPA classificate come possibili cancerogeni siano ben sette. |
| Ruolo in Atmosfera |
Data la stabilità della loro struttura, gli idrocarburi policiclici aromatici risultano piuttosto inerti. In atmosfera questi composti si trovano principalmente nel materiale particellare: benché essi vengano emessi in fase vapore, infatti, a causa della loro bassa tensione di vapore, condensano rapidamente e si adsorbono sulle particelle carboniose. |
Altri Inquinanti Primari
|
Il solfuro di idrogeno, H2S, dovuto ai processi di desolforazione dei petroli in genere e delle benzine in particolare e dei gas naturali. |
|
|
Tiofene e mercaptani emessi da raffinerie e cokerie, facilmente individuabili a causa del loro sgradevole odore. |
|
|
Il piombo, in varie forme volatili, diffuso dai gas di scarico degli autoveicoli alimentati con benzine etilate, contenenti cioè piombo tetraetile come additivo antidetonante; |
|
|
Acidi inorganici e organici (solforico, cloridrico, fluoridrico, bromidrico, acetico, fumarico, tannico, ecc.) liberati nelle combustioni o in cicli industriali diversi. |
|
|
Prodotti radioattivi artificiali dovuti, oltre che alle esplosioni atomiche, a lavorazione di sostanze radioattive per l'utilizzazione pacifica dell'energia nucleare, all'impiego di nuclidi radioattivi nella ricerca scientifica, nell'industria, in campo medico e in agricoltura; |
|
|
Cloro, acido cloridrico e microinquinanti organoclorurati liberati dalla decomposizione di materie plastiche clorurate per incenerimento. |
GLI INQUINANTI SECONDARI
| O3 (Ozono) |
|
La quasi totalità della riserva planetaria di ozono si trova localizzata fra i 15 e i 50 Km di altezza, in una zona chiamata stratosfera, e in particolare nella fascia compresa fra i 20 e i 30 Km, detta appunto ozonosfera. La quantità di ozono presente nella stratosfera viene mantenuta costante mediante un equilibrio dinamico fra la reazione di formazione e quella di fotolisi. La formazione predomina ad un altitudine superiore ai 30 Km, dove la radiazione UV avente lunghezza d’onda inferiore ai 242 nm dissocia l’ossigeno molecolare, largamente presente, in ossigeno atomico; questo si combina rapidamente con un’altra molecola di ossigeno a formare la molecola triatomica dell’ozono. L’effetto netto della reazione è la conversione di tre molecole di ossigeno in due molecole di ozono. Le molecole di ozono formate assorbono a loro volta la radiazione solare di lunghezza d’onda compresa fra 240 e 320 nm, subendo fotolisi e dando luogo ad una molecola ed un atomo di ossigeno. Questo assorbimento della radiazione solare ha l’importantissimo effetto di schermare la terra da più del 90% delle radiazioni UV dannose per la vita sul nostro pianeta. Nella troposfera, ed in particolare in vicinanza del suolo, le radiazioni ultraviolette ad elevata energia necessarie per la formazione di ozono dalla fotolisi dell'ossigeno sono quasi totalmente schermate, e quindi questo meccanismo di formazione non è attivo. I livelli troposferici naturali di ozono sarebbero dunque molto bassi e legati al minimo scambio esistente fra la stratosfera e la troposfera e all'attività fotochimica associata ai processi emissivi naturali. In condizioni naturali, cioè, l’ozono sarebbe quasi del tutto confinato in una zona non a diretto contatto con la vita. L’alterazione dell’equilibrio naturale avvenuta nel corso degli ultimi decenni ha provocato l’attivazione di fenomeni fotochimici di notevole entità in prossimità del suolo, con produzione di quantità rimarchevoli di ozono; la concentrazione di fondo di O3 è infatti più che raddoppiata nell'ultimo secolo e, nelle aree urbanizzate ed industrializzate è aumentata dell’1-2% annuo nel corso dell’ultimo decennio. In particolare, in condizioni di smog fotochimico i livelli di ozono possono raggiungere concentrazioni molto elevate (150-200 ppb) e quindi questa specie deve essere considerata non solo un inquinante della troposfera, ma anche un pericolo per la salute e per l'ambiente. |
|
| Sorgenti |
L’ozono, è uno degli inquinanti secondari dell'atmosfera che hanno origine dagli inquinanti primari per effetto di complesse reazioni fotochimiche causate dalla radiazione solare. Nella troposfera la sorgente principale di ozono è rappresentata dall'ossigeno atomico messo a disposizione dalla fotolisi del biossido d'azoto: NO2 + hn--> NO + O O + O2 --> O3 I processi che determinano la produzione di biossido d’azoto, e quindi di ozono, vanno sotto il nome di processi radicalici fotochimici, nell’ambito dei quali l'ozono rappresenta la specie fotochimica più importante. L’ozono viene rimosso per fotolisi e per reazione con composti organici volatili e con ossidi di azoto. |
| Effetti sulla salute e sull’ecosistema |
Lo smog fotochimico, oltre a effetti irritanti e tossici sull'uomo (occhi e vie respiratorie) provoca danni particolarmente gravi alla vegetazione. La concentrazione dell'ozono nell'atmosfera è rilevata come indice della presenza di smog fotochimico: l'OMS ha stabilito un massimo di 0,1 ppm. La concentrazione di ozono di origine naturale varia tra 0,01 e 0,04 ppm; in alcune città della California sono state raggiunte punte di 0,9 ppm, mentre nelle grandi città italiane difficilmente sono stati superati gli 0,3 ppm. Gli effetti irritanti dell'ozono (bruciore agli occhi e irritazione alla gola) si manifestano già alla concentrazione di 0,1 ppm. Gli effetti biologici nocivi dell’ozono sono legati alle sue proprietà ossidanti. Per quanto riguarda la salute umana, l’ozono in concentrazione superiore agli 80 ppb ha effetti acuti sui polmoni, le cavità nasali e la gola (ma i soggetti sensibili, ad es. gli asmatici, risentono degli effetti dell’ozono anche a concentrazioni più basse). Per quanto riguarda la vegetazione, l’effetto ossidante della molecola si esplica nell’inibizione della fotosintesi e del trasporto delle sostanze nutrienti dalle radici alle foglie e nell’accelerazione del l’invecchiamento. L’ozono provoca inoltre danni ai materiali ed ai monumenti, causando un depauperamento del patrimonio culturale ed artistico, nonchè ingenti perdite economiche. Tra gli effetti dell’ozono troposferico sull’ecosistema bisogna anche annoverare il suo contributo all’effetto serra, dovuto alla capacità di questa molecola di assorbire nell’infrarosso (l’effetto di una molecola di ozono è pari a circa 2000 volte quello di una molecola di anidride carbonica). |
| Ruolo in Atmosfera |
Oltre ad essere un prodotto dell'inquinamento fotochimico, l’ozono è anche un precursore di radicali OH, e quindi un iniziatore di processi fotochimici: O3 +hn --> O2 + O O + H2O --> 2OH Il ruolo di questa specie nei processi di inquinamento fotochimico ossidativo è quindi di primaria importanza. La concentrazione di ozono in atmosfere inquinante può variare da qualche ppb a 200-250 ppb. La concentrazione di fondo di questo inquinante varia invece, alle nostre latitudini, fra i 30 ed i 70 ppb, a seconda del periodo dell’anno. |
| NO2 (Biossido di azoto) |
| Sorgenti |
Il biossido d'azoto (NO2) emesso direttamente nei processi di combustione costituisce non più del 5% degli ossidi di azoto totali. La presenza in atmosfera di quantità elevate di biossido di azoto è dovuta alla rapida ossidazione del monossido d'azoto da parte di ossidanti quali l’ozono e i radicali perossido generati durante i processi di ossidazione dei composti organici volatili. |
| Effetti sulla salute e sull’ecosistema |
Concentrazioni atmosferiche elevate di biossido di azoto possono causare all'uomo irritazione delle vie respiratorie e diminuzione delle funzioni polmonari. Sono stati anche ipotizzati effetti negativi sulla crescita delle piante. Il colore giallo-bruno di questa molecola causa inoltre riduzione della visibilità. |
| Ruolo in Atmosfera |
Il biossido d'azoto gioca un ruolo centrale nei fenomeni di inquinamento fotochimico in quanto è l'intermedio fondamentale per la produzione di ozono, acido nitrico, perossiacetilnitrato, acido nitroso e di tutta una serie di nitrocomposti tra cui gli idrocarburi policiclici aromatici nitrati. La concentrazione atmosferica di biossido di azoto varia tra alcune decine e circa 200 ppb. |
| CH3(CO)-O-ONO2 (PerossiAcetilNitrato) | 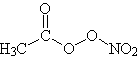 |
| Sorgenti |
Il perossiacetilnitrato (PAN) è un nitrocomposto organico che si forma in atmosfera in periodi di intensa attività ossidativa. Il perossiacetinitrato si forma dalla reazione tra biossido di azoto e radicale perossiacetile, derivante a sua volta dall'ossidazione fotochimica di idrocarburi, aldeidi e chetoni, ovvero a partire da specie che a loro volta sono inquinanti secondari. La reazione di dissociazione del PAN a riformare NO2 e radicale perossiacetile è fortemente dipendente dalla temperatura: ad esempio, il suo tempo di vita medio, che alla temperatura di 27°C è di circa 30 minuti, sale a circa tre giorni alla temperatura di 17°C. |
| Effetti sulla salute e sull’ecosistema |
L’effetto del PAN sulla salute umana consiste essenzialmente nell’irritazione degli occhi; questa specie è inoltre responsabile di effetti fitotossici. Il perossiacetilnitrato è responsabile del blocco enzimatico della fotosintesi e insieme all'ozono, esaltando la respirazione dei vegetali, provoca un abnorme depauperamento delle loro sostanze nutritive. |
| Ruolo in Atmosfera |
A causa della sua via di formazione esclusivamente fotochimica, è possibile osservare concentrazioni atmosferiche elevate di PAN se e solo se sono attivi ed intensi in atmosfera i processi ossidativi. Per questa ragione il PAN viene considerato come un efficace indicatore di attività fotochimica. Il suo ridotto tempo di vita medio lo rende inoltre un utile indicatore di fenomeni di trasporto a breve distanza. |
| HNO3 (Acido Nitrico) |
| Sorgenti |
La principale sorgente dell’acido nitrico in atmosfera è la reazione del biossido d'azoto con i radicali ossidrile (OH) durante gli eventi di smog fotochimico. |
| Effetti sull’Ecosistema |
Gli effetti diretti dell’acido nitrico sono legati al carattere fortemente acido della molecola. La molecola di acido nitrico è molto stabile ma in atmosfera viene velocemente rimossa sia per reazione con ammoniaca (con formazione di particelle di nitrato d'ammonio, che causano diminuzione della visibilità) che per deposizione diretta sulle superfici e adsorbimento sulle gocce d'acqua; mediante quest’ultima via l’acido nitrico contribuisce ai processi di deposizione acida. |
| Ruolo in Atmosfera |
L'acido nitrico rappresenta uno dei composti terminali della catena fotochimica, nonché una importante via di rimozione del biossido di azoto. La presenza di acido nitrico in atmosfera costituisce un indice di attività fotochimica. La concentrazione atmosferica dell’acido nitrico varia da poche unità a 20-30 ppb. |
| HNO2 (Acido Nitroso) |
| Sorgenti |
L'acido nitroso ha origine principalmente dalla reazione tra biossido d'azoto e acqua, che ha carattere eterogeneo (avviene sulle superfici). |
| Effetti sulla salute |
Gli effetti sulla salute dell’acido nitroso sono attualmente poco noti; sembra accertato che l'acido nitroso sia uno dei precursori delle nitrosoammine cancerogene ed abbia effetti mutagenici. |
| Ruolo in Atmosfera |
L'acido nitroso è un composto chiave per il realizzarsi di fenomeni di smog fotochimico, in quanto la sua fotolisi costituisce la principale sorgente di radicali ossidrile (OH) in periodi di bassa intensità della radiazione solare (prime ore del mattino, periodi invernali), ovvero nei periodi nei quali la fotolisi delle altre specie che danno luogo a radicali OH (ozono e formaldeide) è ancora scarsamente efficace. La concentrazione atmosferica dell’acido nitroso varia da poche unità a 10-20 ppb. |
| HCHO (Formaldeide) | 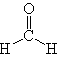 |
| Sorgenti |
Le sorgenti atmosferiche di formaldeide, composto organico ossigenato volatile, sono costituite principalmente dall’ossidazione degli idrocarburi. Nelle aree urbane, ed in particolare nelle aree mediterranee, dove l'attività ossidativa dell'atmosfera è intensa, si riscontrano concentrazioni elevate di formaldeide che sono essenzialmente da attribuire a processi fotochimici. |
| Effetti sulla salute |
La formaldeide è stata recentemente indicata come potenziale composto mutagenico. |
| Ruolo in Atmosfera |
La formaldeide in presenza di radiazione UV si dissocia a formare radicali OH, che innescano la catena fotochimica. Insieme all'ozono e all'acido nitroso la formaldeide è quindi un precursore dello smog fotochimico, oltre ad essere un prodotto di tali processi. La concentrazione atmosferica della formaldeide varia da poche unità a qualche decina di ppb. |
| Composti inorganici in fase particellare: NO3- (Nitrati) |
| Sorgenti |
In condizioni di inquinamento fotochimico si osserva in atmosfera la formazione di un gran numero di particelle di dimensioni tali da determinare una forte riduzione della visibilità (per questo motivo i processi fotochimici vengono spesso indicati come "smog"). In condizioni di smog fotochimico, le specie inorganiche più abbondanti in fase particellare sono i nitrati, formati a partire dall’acido nitrico (uno dei prodotti terminali della catena ossidativa) sia per reazione veloce con l'ammoniaca (formazione di nitrato d'ammonio) che per deposizione sul materiale particellare. |
| Effetti sulla salute |
Concentrazioni elevate di composti inorganici in fase particellare possono causare all'uomo irritazione delle vie respiratorie. |
| Ruolo in Atmosfera |
I nitrati in fase particellare rappresentano uno dei composti terminali della catena fotochimica, nonché una delle specie coinvolte nei processi di deposizione acida. |
| Nitro-IPA: C16H9NO2 (2-Nitrofluorantene) | 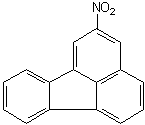 |
| Sorgenti |
Gli idrocarburi policiclici aromatici nitrati (Nitro-IPA) sono composti organici caratterizzati dalla presenza di uno o più gruppi nitro (NO2) che sostituiscono gli idrogeni presenti nelle strutture degli idrocarburi policiclici aromatici. Le sorgenti atmosferiche dei Nitro-IPA sono le reazioni di combustione in presenza di ossidi di azoto e le reazioni radicaliche tra gli IPA e gli agenti nitranti prodotti durante i fenomeni di smog fotochimico. |
| Effetti sull’Ecosistema |
I Nitro-IPA sono da tempo oggetto di studio per il loro impatto sulla salute dell'uomo. Fra i Nitro-IPA uno dei composti dotati di maggior potere mutageno è il 2-Nitrofluorantene, che si forma essenzialmente durante gli eventi di smog fotochimico. |
| Ruolo in Atmosfera |
La presenza in atmosfera dei Nitro-IPA costituisce un indice dei fenomeni di inquinamento fotochimico. |